Tabla de Contenidos
- ¿Por qué los primeros metales no presentaban corrosión?
- ¿Cómo ha evolucionado la investigación sobre corrosión?
- Avances del siglo XIX: Edison y la protección catódica
- Teorías de principios del siglo XX
- Conclusiones
- Referencias
- Preguntas frecuentes (FAQs)
- ¿Qué metales fueron los primeros en usarse sin problemas graves de corrosión?
- ¿Quién estableció que la corrosión metálica era un fenómeno electroquímico?
- ¿Cuál fue la contribución de Michael Faraday al estudio de la corrosión metálica?
- ¿Qué importancia tuvieron los trabajos de Pourbaix en 1938?
- ¿Qué técnicas modernas se utilizan para prevenir la corrosión?
La corrosión metálica es uno de los fenómenos más estudiados en la ciencia de materiales, ya que representa un desafío constante para la industria, la ingeniería y la tecnología moderna. Desde los primeros usos del cobre, el oro y el hierro hasta la implementación de sofisticados sistemas de protección catódica, la historia de la corrosión refleja el avance del conocimiento científico y el impacto económico de este fenómeno.
Este artículo analiza los hitos más relevantes en la comprensión de la historia de la corrosión metálica, desde los descubrimientos iniciales en el siglo XVIII hasta los desarrollos tecnológicos aplicados en el siglo XX, con especial énfasis en las investigaciones que marcaron la evolución de las teorías electroquímicas y las soluciones prácticas adoptadas por la industria.
¿Por qué los primeros metales no presentaban corrosión?
Los primeros metales empleados por las civilizaciones antiguas fueron aquellos que podían encontrarse en estado nativo (noble), como el oro, el cobre y la plata, o aquellos que podían reducirse fácilmente al estado elemental; por lo cual, no tendían a pasar con facilidad al estado combinado, lo que limitaba significativamente los problemas de corrosión.

El escenario cambió radicalmente con la introducción del hierro. Su gran reactividad y tendencia a formar compuestos como los óxidos dejaron en evidencia la verdadera magnitud del problema de la corrosión metálica, que pasaría a ser objeto de investigación científica durante los siglos posteriores.
¿Cómo ha evolucionado la investigación sobre corrosión?
Primeras observaciones siglo XVIII
En el siglo XVIII, el investigador Austin en el año1788, realizó una de las primeras observaciones sistemáticas sobre los efectos del agua en contacto con el hierro. Notó que el agua, inicialmente neutra, tendía a adquirir un carácter alcalino tras su interacción con el metal: lo cual lo explico como un fenómeno causado a partir de la generación de hidróxido de sodio como producto catódico dentro de las reacciones electroquímicas propias de la corrosión en medios salinos (Cottis, 2000).
Este hallazgo constituyó un antecedente importante al evidenciar que la corrosión no era únicamente un proceso químico simple de disolución o combinación directa con el oxígeno, sino que involucraba transformaciones más complejas asociadas al comportamiento del hierro en ambientes acuosos.
Posteriormente, en 1819, el químico francés Louis Jacques Thénard avanzó en la comprensión del fenómeno al proponer que la corrosión debía interpretarse como un proceso de naturaleza electroquímica. Este planteamiento representó un hito significativo, ya que sentó las bases para el desarrollo de un marco teórico más sólido en torno a los mecanismos de degradación metálica.
Las observaciones de Thénard abrió el camino a una nueva perspectiva científica en la que la corrosión ocurría como resultado de reacciones de óxido-reducción distribuidas en diferentes áreas de la superficie metálica, con formación de regiones anódicas y catódicas interdependientes. Esta interpretación, para la época, marcó el inicio de la transición hacia una explicación más rigurosa y cuantificable del problema de la corrosión, que continuaría desarrollándose a lo largo de los siglos XIX y XX (Cottis, 2000).
Faraday y la conexión entre química y electricidad
Entre 1834 y 1840, Michael Faraday realizó una serie de investigaciones experimentales que transformaron la comprensión de la electricidad y la química, demostró que las reacciones químicas podían generar corrientes eléctricas y que la electricidad podía inducir cambios químicos en los electrolitos, estableciendo un vínculo conceptual entre ambos campos.
Contribuyó a la comprensión y control de la corrosión al descubrir las leyes de la electrólisis, que establecen que la cantidad de metal depositado o disuelto es proporcional a la carga eléctrica que pasa a través de la solución e introdujo conceptos fundamentales como electrodo, electrolito, ánodo, cátodo, catión y anión, los cuales permanecen vigentes como la terminología básica de la electroquímica.

Estos descubrimientos marcaron la historia de la corrosión y fueron fundamentales para estudiar la corrosión metálica, al mostrar que no se trataba solo de un deterioro superficial, sino de un proceso electroquímico donde regiones anódicas y catódicas interactúan a través de un electrolito. Este enfoque permitió comprender fenómenos como la disolución localizada, la formación de óxidos y la influencia de factores como la conductividad del medio o la presencia de electrolitos , constituyendo los cimientos de la electroquímica moderna.
Avances del siglo XIX: Edison y la protección catódica
En 1890, Thomas A. Edison patentó un sistema rudimentario de protección catódica basado en la aplicación de corrientes impresas mediante un ánodo inerte de grafito. Aunque su enfoque era principalmente experimental y limitado por la tecnología de la época, este método sentó las bases conceptuales de la protección catódica moderna. La idea central era contrarrestar la corrosión natural de los metales, convirtiendo las superficies metálicas en cátodos y evitando su oxidación al suministrarles una corriente eléctrica externa.
Este avance histórico fue fundamental porque introdujo el principio de controlar electroquímicamente la corrosión, que hoy se aplica ampliamente en tuberías de transporte de agua y petróleo, cascos de embarcaciones, plataformas offshore y otras infraestructuras críticas, sin embargo este principio no se pudo aplicara ya que no se contaba con los materiales y la energía para desarrollar esta idea. Los sistemas actuales, más sofisticados y automatizados, conservan el mismo concepto básico que Edison desarrolló: proteger las estructuras metálicas mediante la inversión de las reacciones electroquímicas responsables de su deterioro.
A inicios del siglo XIX, con los trabajos de Humphry Davy (1810–1820) sobre protección catódica y de Michael Faraday (1830s) sobre las leyes de la electrólisis, se consolidó la idea de que la corrosión del hierro en presencia de agua y oxígeno era un proceso electroquímico.
A lo largo de la segunda mitad del siglo XIX, se detalló el mecanismo anódico (disolución del hierro como Fe²⁺) y catódico (reducción de oxígeno en el agua), lo que sentó las bases modernas para comprender la corrosión en hierro expuesto al aire húmedo.
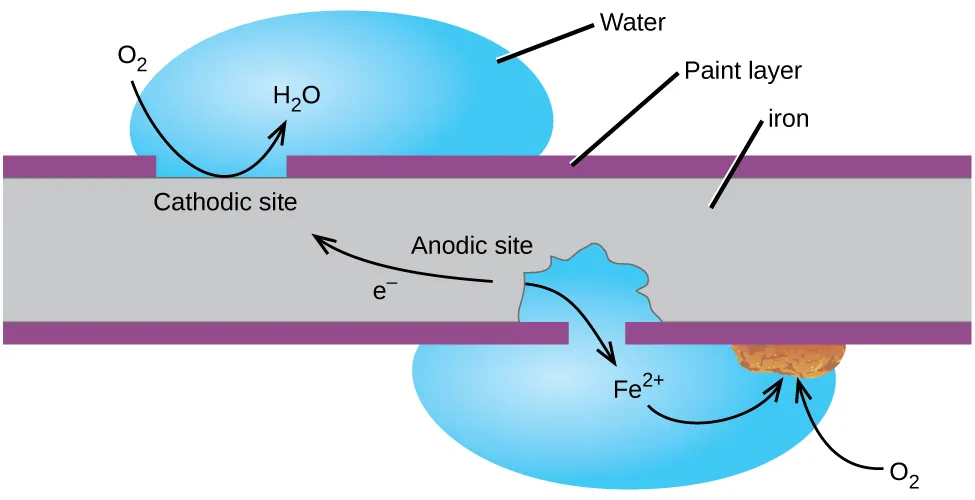
Teorías de principios del siglo XX
Durante el 1908, se desarrolló la teoría de que los ácidos eran los principales responsables de la corrosión. En particular, se atribuía al ácido carbónico el origen del óxido en el hierro.
Alrededor de 1900 surgió también la hipótesis de que el peróxido de hidrógeno actuaba como intermediario en el proceso corrosivo. Más tarde se estableció que dicho compuesto se forma cuando existe un exceso de oxígeno en el cátodo. Sin embargo, en 1905, Dunstan, Goulding y Jowett demostraron que el hierro expuesto al agua y oxígeno podía corroerse incluso sin la presencia de ácido carbónico, lo que refutaba parcialmente la teoría anterior.
Investigaciones internacionales y consolidación de teorías
En 1907, los investigadores estadounidenses Walker, Cederholm y Bent aceptaron la corrosión en líquidos neutros con la participación del oxígeno como estimulador catódico.
En 1910, los alemanes Heyn y Bauer realizaron amplias investigaciones en hierro y acero, estableciendo por primera vez medidas cuantitativas de velocidad de corrosión en diferentes medios. Estos estudios confirmaron que el ataque del hierro se intensifica en contacto con un metal más noble, mientras que el contacto con un metal más activo puede ofrecer protección parcial o total. Este fenómeno ya había sido anticipado en 1824 por Sir Humphry Davy, quien propuso proteger el cobre de los buques británicos mediante hierro o zinc frente a la acción del agua de mar.
En el ámbito de los recubrimientos protectores, actualmente, gracias a los avances en nanotecnología, en investigación y producción de revestimientos grafénicos, ha desarrollado una nueva tecnologia de efecto barrera anticorrosiva. Estos productos incorporan óxido de grafeno (GO) y arcilla, aditivos nanotecnológicos que confiere una elevada protección frente a la corrosión al crear trayectorias tortuosas que dificultan la difusión de moleculas de oxígeno y agua hacia la superficie metálica, evitando así el inicio de los procesos de deterioro.
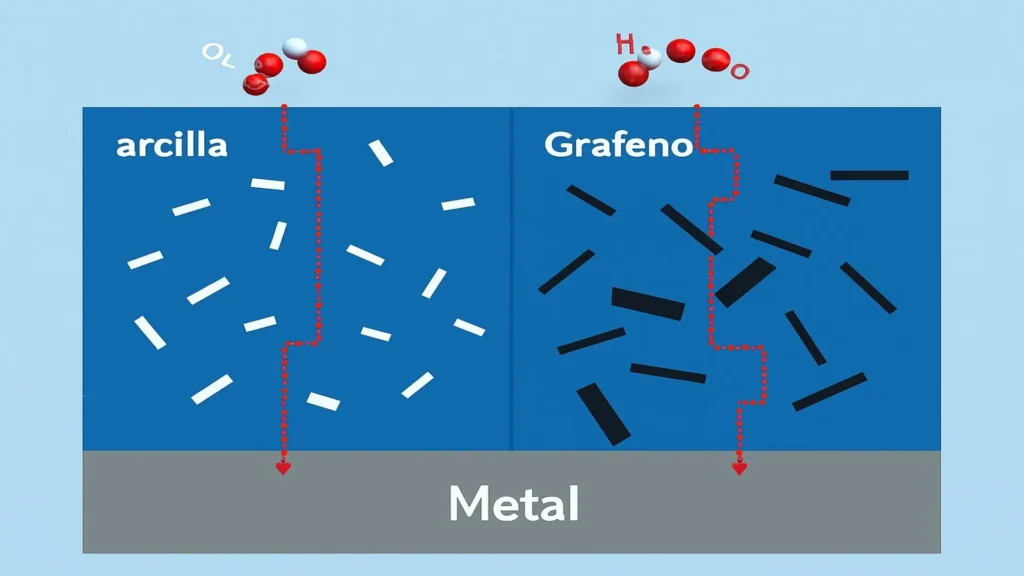
El mecanismo de acción de estos recubrimientos se sustenta en dos vías principales: como barrera física, limitando en gran medida la penetración de especies agresivas, y como inhibidores electroquímicos, al incrementar la resistividad eléctrica e iónica, interrumpiendo de esta manera el ciclo corrosivo. Esta doble estrategia los posiciona como soluciones altamente efectivas para la protección de estructuras metálicas en condiciones industriales demandantes.
Impacto en la Primera Guerra Mundial
Durante la guerra de 1914-1918, la corrosión de los tubos de los condensadores marinos y de los cables de remolque en ambientes marítimos se convirtió en un problema crítico para la Marina británica, hasta el punto de generar más preocupación que la propia flota enemiga.
Las investigaciones del Comité de Corrosión del Institute of Metals y de la British Non-Ferrous Research Association permitieron el desarrollo de nuevas aleaciones resistentes a la corrosión, mejorando sustancialmente la situación.
Avances en el siglo XX
En 1938, el belga Marcel Pourbaix revolucionó el con sus aportaciones en termodinámica aplicada, introduciendo los diagramas que llevan su nombre. Estos representaban gráficamente la estabilidad de los metales en función del pH y el potencial electroquímico, constituyendo una herramienta esencial en la ciencia de materiales.
Paralelamente, las industrias petrolera y naval desarrollaron técnicas avanzadas de protección anticorrosiva, impulsando la aplicación práctica de los conocimientos adquiridos.
Conclusiones
La investigación sobre la corrosión metálica ha evolucionado desde los estudios fundamentales de Faraday y los primeros sistemas de protección catódica de Edison hasta los enfoques multidisciplinarios actuales que integran la electroquímica, la microbiología, los materiales avanzados y las tecnologías de monitorización, lo que nos permite comprender los mecanismos de deterioro y diseñar estrategias de prevención eficaces.
Los avances históricos y recientes en el control de la corrosión metálica han sido fundamentales para proteger las infraestructuras críticas, optimizar la vida útil de los materiales y reducir los costes industriales, lo que pone de relieve la importancia de seguir desarrollando soluciones sostenibles y tecnológicamente sofisticadas.
Referencias
- Cottis, R. A. (2000). Electrochemical corrosion. In C. C. Nathan (Ed.), Uhlig’s Corrosion Handbook (2nd ed., pp. 51–54). Wiley-Interscience.
- Bockris, J. O’M., & Reddy, A. K. N. (1970). Modern electrochemistry: An introduction to an interdisciplinary area (Vol. 1). Plenum Press.
- Revie, R. W. (Ed.). (2000). Uhlig’s corrosion handbook (2nd ed.). Wiley-Interscience.
Preguntas frecuentes (FAQs)
¿Qué metales fueron los primeros en usarse sin problemas graves de corrosión?
Principalmente oro, cobre y plata, ya que podían encontrarse en estado nativo y no se combinaban fácilmente con otros elementos.
¿Quién estableció que la corrosión metálica era un fenómeno electroquímico?
El científico francés Louis Jacques Thénard, en 1819.
¿Cuál fue la contribución de Michael Faraday al estudio de la corrosión metálica?
Demostró la relación entre reacciones químicas y generación de corrientes eléctricas, sentando las bases de la electroquímica.
¿Qué importancia tuvieron los trabajos de Pourbaix en 1938?
Introdujo los diagramas de potencial-pH, fundamentales para predecir la estabilidad de los metales y sus reacciones en diferentes medios.
¿Qué técnicas modernas se utilizan para prevenir la corrosión?
Protección catódica, recubrimientos especializados, uso de aleaciones resistentes y monitoreo electroquímico en tiempo real.

